“NMT介绍”的版本间的差异
小 (导入1个版本) |
|
(没有差异)
| |
2016年10月9日 (日) 12:54的版本
NMT介绍
技术概况
非损伤微测技术(NON-INVASIVE MICRO-TEST TECHNIQUE,NMT)是实时测定进出活体材料离子和小分子流速的技术,是生理功能研究的最佳工具之一。
非损伤微测技术(NMT) 自从1974年美国海洋生物学实验室(MBL,Marine Biological Laboratory)的神经科学家Lionel F. Jaffe提出原初概念,到1990年成功应用于测定细胞的Ca2+流速,已经解决了众多科学问题。今天,非损伤微测技术在生命科学、环境科学、材料科学等领域广泛应用,在国际顶尖杂志《Science》(封面)、 《Nature》、《PNAS》、《Plant Cell》、《Environmental Science & Technology》等发表了大量科研成果。非损伤微测技术的活体、动态和实时的测量方式,以及高分辨率和高灵敏度,将加深人类在科研领域的工作,促进对自然界的认识。
基于非损伤微测技术的整套仪器——非损伤微测系统,已经由美国扬格公司 (YoungerUSA,LLC) 完全商业化,并且建立了完善的售后服务体系,应用在科研的各个领域。2011年,美国扬格公司推出了在中国组装的非损伤微测系统,将推动非损伤微测技术在中国的普及。
基于非损伤微测技术的测试服务,已经为国内外的大学和研究所提供了世界一流的数据。在美国扬格(旭月公司)非损伤技术服务中心完成的非损伤微测技术实验,短短5年内发表近70篇高水平文章,影响因子累计超过294。
基于非损伤微测技术的专利项目,旭月公司获批的专利超过20项,正在进行相关的产业化项目,得到了政府的大力支持和投资人的青睐。
非损伤微测技术目前可以测定IAA、Pb2+、Ca2+、H+、K+、Mg2+、Na+、Cd2+、Cl-、NH4+、NO3-、O2、H2O2浓度、流速和三维运动方向的信息,具有活体、动态、实时、内外兼测、长时间、多维扫描与测量的特点,测定的材料不限,包括整体、器官、组织、细胞层、单细胞甚至是富集的细胞器。随着技术的发展,非损伤微测技术能够测量的离子分子种类也在不断增加,如将可以测定NO、Glucose和Glu等分子的流速。
技术原理
非损伤微测技术是通过微电极和微传感器获取离子和分子的信号,基于Nernst方程和Fick's第一扩散定律计算离子和分子的浓度和流速,能够获得非常细微的信号,流速能够达到10-12 mol • cm-2 • s-1。在生命科学领域,应用非常广泛,是连接生命功能的桥梁。在环境科学领域,非损伤微测技术的高灵敏度是人们探知环境恶化的预警系统。在材料科学领域,对于人们认识材料在液体环境中的性能提供了一个新颖的评价手段。
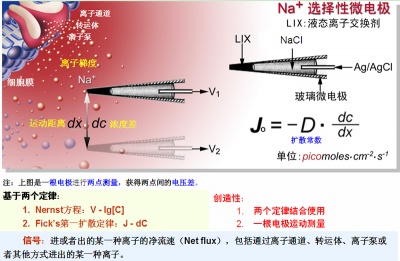
以Na+浓度梯度和Na+微电极为例说明非损伤微测技术离子选择性微电极的工作原理。
Na+离子选择性微电极通过前端灌充液态离子交换剂(Liquid Ion Exchanger,LIX)实现Na+的选择性。该微电极在待测离子浓度梯度中以已知距离dx进行两点测量,分别获得电压V1和V2。两点间的浓度差dc则可以从V1、V2及已知的该微电极的电压/浓度校正曲线(基于Nernst方程)计算获得。D是离子的扩散常数( 单位:cm2•sec-1),将它们代入Fick第一扩散定律公式J = - D • dc/dx,可获得该离子的流动速率(pico mol • cm-2 • s-1) 即:每秒钟通过每平方厘米的该离子/分子摩尔数(10-12级)。
非损伤微测技术的测量有如下优势:
- 活体、原位、非损伤测定:生理功能研究,获取正在发生的信息
- 时间分辨率高:0.3s;2-5s,能够快速获得细胞的早期事件
- 空间分辨率高:0.5μm;2μm,能够测定单细胞,甚至原生质体、液泡等细胞器
- 灵敏度高:10-12 mol • cm-2 • s-1或更低
- 长时间测量:1h,24h,甚至7天或更长
- 多种离子同时测量:研究离子间的相互关系
- 不用提取样品:直接测量,不需要研磨等传统的提取方法
- 动态实时测量:动态实时地测量和获取数据,可视化结果
- 操作便捷:很多操作通过自动控制可以实现
- 多个尺度上的测量:整体、器官、组织、细胞、甚至细胞器都可以测量(大于5μm)
- 多维扫描与测量:一维、二维、三维方向测定,获取数据空间数据
NMT与Confocal
激光共聚焦技术与非损伤微测技术结合的优势
2008年诺贝尔化学奖授予三位发现荧光蛋白的科学家,表彰他们对生命科学发展的重要贡献。荧光技术是现代生命科学研究中非常重要的技术,也是目前检测生物体样品内离子分子状态的最佳手段。激光共聚焦技术的出现,使荧光技术如虎添翼。通过共聚焦显微镜和飞秒红外激光器等部件的配合使用,不仅可以得到非常清晰的荧光图像,进行多重荧光标记的定位和定量分析,还具有图像三维重建、荧光共振能量转移谱测定甚至膜电位测定等功能,成为生命科学研究的重要技术手段。近年来,应用激光共聚焦技术发表的高水平研究成果越来越多,受到生命科学家的广泛关注。
但随着激光共聚焦技术应用范围的扩大,其在研究中的局限性也突显出来。激光共聚焦技术可以视为对荧光技术的重大改进,但并未对荧光技术做出本质改变,因而荧光技术的固有缺陷也在激光共聚焦技术上体现出来。首先,激光共聚焦技术主要获得的是生物样品内部的离子分子信息,这些离子分子信息的改变既可能源于样品内部离子分子源的变化,也可能源于样品内外的离子分子交换。这两种离子分子变化过程是由完全不同的生命机制引发的。尽管激光共聚焦技术也可以测量生物样品外部的离子分子信息,但存在许多问题影响测量的准确性。这导致共聚焦数据的重大缺陷,必须通过大量的后续实验才能得出比较准确的结论。若单纯用激光共聚焦数据作为检测或诊断标准,往往面临很大的假阳性风险。其次,激光共聚焦测量时必须向生物样品内导入荧光物质,不仅操作过程复杂,而且这些荧光物质对样品活性 有已知或潜在的影响,甚至可能导致样品生理状态改变,造成数据失真。这些问题已经成为激光共聚焦技术发展的瓶颈,严重制约了它的进一步应用。
为克服现有激光共聚焦技术存在的问题,必须使激光共聚焦技术能够同时准确获得被测样品内外的离子分子信息并尽量减轻测试过程中对样品的损伤。现有的激光共聚焦技术体系要实现这两点非常困难,而激光共聚焦技术与非损伤微测技术的结合却可以轻松做到。
非损伤微测技术是一大类选择性/特异性微电极技术的总称。1990年,非损伤微测技术诞生于产生过多位诺贝尔奖获得者的美国MBL实验室(2008年诺贝尔化学奖得主之一下村修曾在该实验室工作多年)。与其他侵入式测量技术最大的区别在于,非损伤微测技术测试过程由电脑自动控制微电极运动,非常接近样品表面而不接触样品进行测量,获得样品外环境的离子分子的绝对浓度、流动速率和流动方向的信息。非损伤性测量是非损伤微测技术的重要特色,测试在与生物样品真实生存环境相似的液体中进行,不导入任何外源物质,最大程度保证了样品的生物活性和生理状态。也正由于测试过程中微电极不需要接触样品,使得非损伤微测技术被测样品范围非常广泛,从动植物整体、器官、组织、细胞聚集体、单个细胞到富集的细胞器均可。而获得离子分子的流动速率和流动方向则是非损伤微测技术的鲜明优势,也是其他技术手段难以获得的重要信息。与浓度反映的离子分子静态信息相比,流动速率和流动方向反映的则是离子分子动态信息,样品外环境的离子分子流动速率和流动方向实质上表征的是样品内外离子分子的交换情况,更能反映生命活动过程的本质。除此之外,非损伤微测技术还具有多电极、长时间、多角度测量等特色。
正因为非损伤微测技术的上述优势和特色,自诞生以来便获得了越来越广泛的应用,迄今已在《Science》、《Nature》 等国际著名杂志发表论文百余篇。非损伤微测技术所获取数据和激光共聚焦技术获取的数据有很大互补性,两者结合可以同时准确检测样品内外离子分子的变化情况,提供生命活动过程的完整信息,明确生命活动机制机理。非损伤微测技术可以测量生命活动中常见的50多种离子和分子,覆盖了激光共聚焦技术的检测范围。而非损伤微测技术在测量时也需要配备显微镜,这使非损伤微测技术和激光共聚焦技术的结合有了硬件基础。
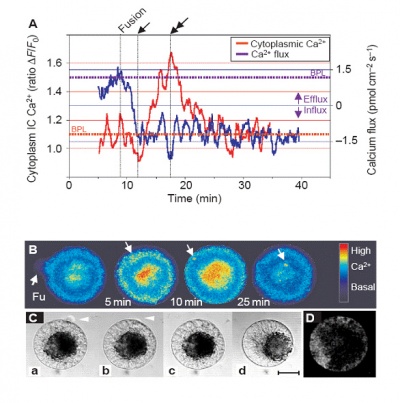
早在2001年,葡萄牙学者在《Nature Cell Biology》发表研究论文,应用非损伤微测技术和激光共聚焦技术同时检测卵细胞与配子融合过程中卵细胞内外Ca2+的变化情况。非损伤微测技术检测发现,在融合一瞬间,胞外Ca2+有一个非常明显的内流,而此时激光共聚焦技术发现胞内Ca2+显著增加,如下图所示。这充分说明卵细胞和配子融合过程中胞外的Ca2+参与了这个重要的生命过程。
上述实例是非损伤微测技术和激光共聚焦技术结合的雏形。非损伤微测技术和激光共聚焦技术的结合瞄准当今生命科学界以揭示生命活动机理和功能为主要研究内容的潮流,全面反映生命活动的信息,所产出数据有很强的说服力,易于产生高水平研究成果。
NMT与膜片钳
非损伤微测技术与膜片钳技术的区别与结合
1976年膜片钳技术的诞生是现代生命科学研究史上的重要事件,两位德国科学家因应用膜片钳技术进行离子通道研究所取得的成就而荣获1991年诺贝尔生理学或医学奖。膜片钳技术对离子通道开闭情况的研究,成为连接生物分子和生物功能研究的重要桥梁,催生了大量高水平研究成果。
但随着膜片钳技术的广泛应用,其许多内在问题也逐步暴露出来。首先,膜片钳技术测量需要通过微电极吸附细胞膜这一过程来实现,操作难度极大,需要实验人员经过长时间训练,而且也严重限制了膜片钳技术检测样品的范围,基本只能用于对生物细胞进行测量。
膜片钳对离子通道的研究具有其他技术不可比拟的优势,但膜片钳技术记录的是电流,对于研究离子跨膜转运,仅仅记录电流有可能造成信息的缺失。研究发现,离子的跨膜转运除离子通道(Ion Channel)外,还有离子载体(Transporter) 这一模式,单纯研究离子通道并不能反映离子转运的全部信息。一方面,离子通过载体实现的转运过程往往比较缓慢,产生的电流非常微弱,膜片钳技术记录很困难;更重要的,如果离子“一进一出”或“一阴一阳”进行转运,会造成总体电中性,不产生电流,也就无法被膜片钳技术所记录。同时,对于中性分子的转运过程,膜片钳技术也无能为力。
除此之外,通过膜片钳技术对离子通道开闭的研究来表征生物功能过程对于许多领域而言太过间接、膜片钳实验的吸膜过程对细胞的严重损伤可能严重影响被测数据的真实性等问题都成为诟病膜片钳技术的焦点。
随着生命科学的发展特别是对生物功能与生理机制的研究逐步成为生命科学研究的主流,广大科技工作者迫切需要一种更加全面、直接和方便的离子分子信息表征技术。
1990年,在美国著名的海洋生物学实验室(Marine Biological Laboratory,MBL),非损伤微测技术应运而生。非损伤微测技术采用离子/分子选择性微电极(此微电极为非损伤微测技术专用,不同于膜片钳或其他技术使用的微电极)接近样品而非接触或非侵入的方式进行测量,获得进出样品表面的离子分子浓度、流动速率和流动方向的数值。由于其特有的非损伤性测量方式,非损伤微测技术被测样品范围非常广泛,从生物整体、器官、组织、细胞层、单细胞直到细胞器都可以进行测量。
非损伤微测技术所获得的离子分子流动速率和流动方向信息,不仅反映了生物生理活动的动态过程,同时也是相对总体的信息,如细胞离子分子流动速率信息反映的是细胞膜上若干个离子通道和离子载体或若干个分子转运过程共同作用的结果,组织离子分子流动速率信息反映的是组织上若干个细胞共同作用的结果,不受离子分子转运方式、转运过程是否电中性因素的影响。这使得非损伤微测技术所获得的离子分子流动信息成为表征生物功能与生理机制非常全面与直接的手段。
非损伤微测技术的实验操作主要是显微操作,不涉及吸附细胞膜等复杂操作过程,非常方便快捷,实验人员经简单培训后即可上手。此外非损伤微测技术还具有长时间、多电极、任意路径测量等其他技术难以比拟的优势。
非损伤微测技术的诸多优势和广泛的适用性,使其自诞生以来便获得越来越广泛的应用,为生命科学研究提供全新视角和思路。诸多不同领域的学者应用非损伤微测技术开展研究工作,在《Nature》、《Nature Protocols》、《PNAS》、《Plant Cell》等著名杂志已发表高水平研究论文百余篇。除生命科学领域外,非损伤微测技术也引起材料科学等其他学科科技工作者的兴趣,在这些学科的研究中也取得丰硕成果。
对研究兴趣集中于离子通道的传统生理学家,尽管膜片钳技术是其主要研究工具,非损伤微测技术同样可以使其研究更加深入和丰满。如澳大利亚学者Shabala等2006年发表于《Plant Physiology》的研究论文,以拟南芥为材料,研究胞外Ca2+对NaCl诱导的K+流失的影响。作者用非损伤微测技术测量拟南芥根部和叶片的K+流,发现胞外Ca2+浓度的增加可以有效抑制NaCl诱导的K+流失;对拟南芥根部原生质体进行膜片钳测量,发现胞外Ca2+可以影响细胞膜上的K+通道的通透性。这些工作使本文的研究结果非常丰满,从细胞到器官不同层次清晰阐述了植物相关生理机制。